Людмила Бабенкова, эмбриолог, Дмитрий Попов, биотехнолог – Центр биотехнологий – Брест, Белгород, Пенза, Элиста
Иван Кысса, доктор биологических наук – белорусско-канадское СООО "Бел-Симекс"
Возникновение в естественных условиях монозиготных близнецов явление
редкое и не превышает 0,01%. Поскольку причины спонтанного разделения
эмбрионов до настоящего времени не выяснены, для повышения многоплодия
определилось новое направление в биотехнологии – искусственное
получение идентичных близнецов с помощью микрохирургических методов.
На сегодняшний день проведение микрохирургических манипуляций с доимплантационными эмбрионами млекопитающих является одним из наиболее перспективных биотехнологических приемов. Их применение позволяет увеличить количество эмбриоматериала для трансплантации и, соответственно, возможное число генетических потомков от наиболее ценных животных.
В основу разработки метода разделения ранних эмбрионов млекопитающих на две части и более путем микрохирургии легло явление тотипотентности отдельных бластомеров, то есть их способность развиваться в полноценный организм в процессе всего онтогенеза.
Тотипотентность изолированных бластомеров млекопитающих была впервые доказана в работах по микроманипуляции эмбрионов мышей [12]. В 1978 г. в эксперименте по пересадке 80 демиэмбрионов, полученных в результате разделения эмбрионов мышей на 8-16-клеточной стадии развития, было получено 30 мышат, из которых идентичные близнецы составили 40%. В этом эксперименте зоны пеллюцида удалялись путем разрезания микроножом или с помощью фермента проназы. Освобожденный зародышевый комплекс разделяли микроманипулятором, а полученные половинки вносили в свободные зоны пеллюцида.
В последующих исследованиях сходная методика использовалась при разделении эмбрионов других видов млекопитающих.
В 1981 г. Вилладсеном С.М. были получены первые монозиготные близнецы у крупного рогатого скота [14, 15]. Уровень приживляемости составил 75%: из 28 демиэмбрионов, пересаженных реципиентам-коровам, родился 21 теленок. Но методика оставалась слишком сложной. Зародышевые комплексы 5-6-дневных морул разделяли после извлечения из зоны пеллюцида, а полученные половинки вводили в пустые зоны ооцитов и в агаровых цилиндрах культивировали в яйцеводах овец.
В последующем удалось отказаться от культивирования демиэмбрионов в яйцеводах животных – промежуточных реципиентов [13] и проводить
микроманипуляции на 6-8-суточных эмбрионах. Но при этом методика оставалась довольно сложной для широкого использования на практике. Необходимо применение специального манипулятора, обеспечивающего независимый контроль 5 инструментов: микроприсоски для удержания эмбриона, двух инструментов для вскрытия зоны пеллюцида и двух для переноса полученных половинок в свободные зоны ооцитов.
В исследованиях ученых Германии (Schwiderski H. et al., 1985 г.) была показана возможность трансплантации половинок эмбрионов без размещения в свободные зоны пеллюцида. Для разделения достаточно одного микроножа, с помощью которого эмбрион разделяют пополам, и после культивирования компактные половинки пересаживают реципиентам. Сообщается о 75%-й стельности, полученной после пересадки реципиентам по 2 половинки.
В настоящее время микрохирургия доимплантационных зародышей вступила в фазу её использования в практических программах по воспроизводству и селекции крупного рогатого скота.
В наших исследованиях методика разделения эмбрионов была максимально приближена к условиям производства [1, 2, 3, 4, 8, 9]. Для разделения эмбрионов на две части (дисекция) использовали два способа.
По первому способу (контроль) дисекцию осуществляли с помощью единственного инструмента – микроножа, закрепленного в держателе микроманипулятора ф.Бахофер (Германия). Нож контролируемо перемещался в горизонтальной и вертикальной плоскостях (фото 1) 
Процесс разделения осуществлялся следующим образом. Эмбрионы помещали в чашку Петри и кромкой лезвия разделяли в вертикальной плоскости через зону пеллюцида строго пополам (рис. 1). 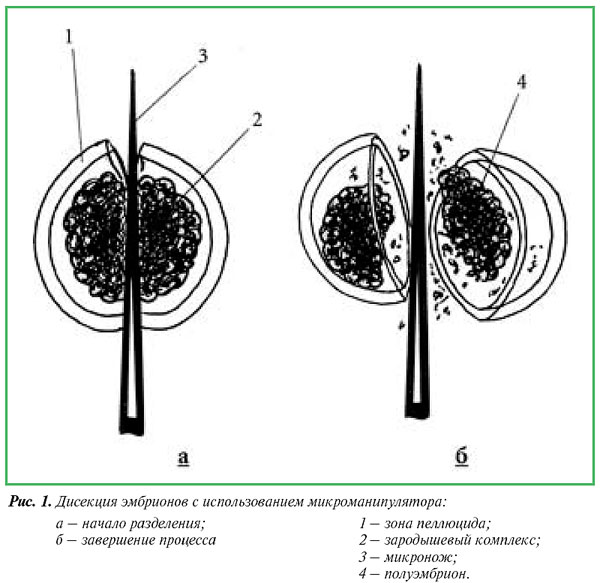
Полученные демиэмбрионы без размещения в свободные зоны пеллюцида кратковременно культивировали, а затем пересаживали телкам-реципиентам.
По разработанному нами второму способу (опыт) было сконструировано специальное устройство [1] (рис. 2). 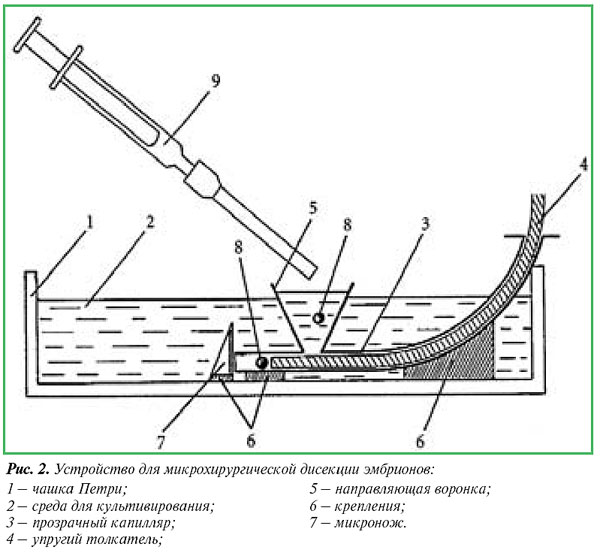
Устройство монтируется в чашке Петри и представляет собой изогнутый стеклянный капилляр с расширенным до 3 мм входным и суженным до 150-170 мкм выходным отверстиями. Вплотную к выходному отверстию строго по центру в вертикальном положении закрепляется микронож (сегмент лезвия безопасной бритвы). Капилляр и микронож жестко крепятся на дне чашки Петри, куда наливается среда для культивирования. Эмбрион для разделения переносится во входное отверстие капилляра, свободно опускается в его суженную часть, а затем с помощью тонкой стеклянной нити, выполняющей роль поршня, проталкивается к выходному отверстию и простым надавливанием непосредственно через зону пеллюцида рассекается строго пополам (рис. 3). 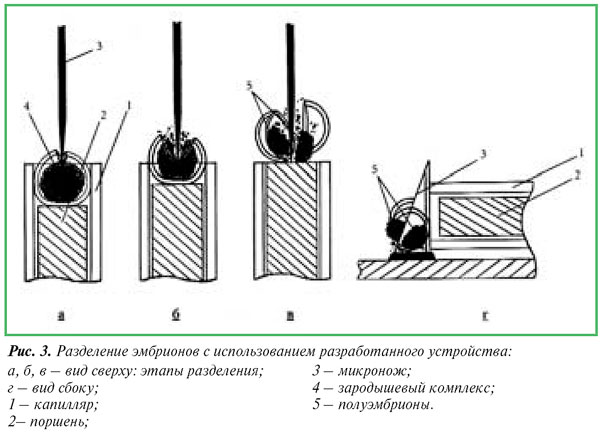
Полученные половинки могут быть немедленно отобраны для кратковременного культивирования и пересадки. На процедуру дисекции затрачивается не более трёх минут.
С использованием первого способа был разделен 61 эмбрион и получено 116 равноценных половин, что составило 95,1% от числа максимально возможных (122) (табл. 1). 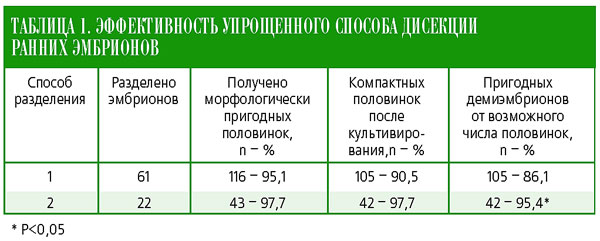
>После культивирования компактизация зародышевого комплекса была отмечена у 105 половинок (90,5%), которые по одной или по две были пересажены реципиентам.
Таким образом, эффективность дисекции эмбрионов при использовании первого способа составила 86,1%: из 122 максимально возможных было получено 105 пригодных для трансплантации демиэмбрионов.
С помощью разработанного устройства разделили 22 эмбриона, получили 43 половинки (97,7%), после культивирования которых 42 (97,7%) были пригодными для трансплантации. Эффективность разделения эмбрионов по второму способу составила 95,4% (из 44 возможных получили 42 пригодных демиэмбриона), что было выше по сравнению с первым способом на 9,3% при статистически достоверной разнице (Р<0,05).
Полученные демиэмбрионы по одному или по два пересаживали телкам-реципиентам. Эффективность трансплантации была сопоставлена с пересадкой свежеполученных интактных эмбрионов при тех же условиях (табл. 2). 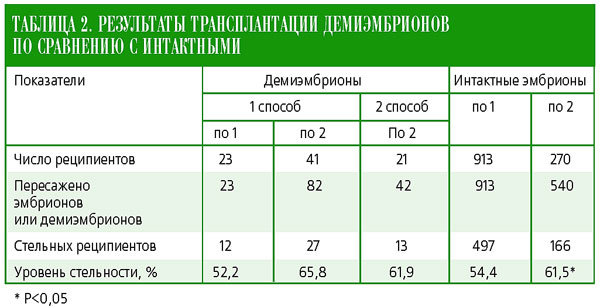
При пересадке реципиентам по одному демиэмбриону приживляемость практически не изменялась по сравнению с пересадкой одного интактного эмбриона – 52,2% против 54,4%. Аналогичный результат был получен после пересадки двух демиэмбрионов: по первому способу из 41 реципиента стельность установили у 27 голов (65,8%), а по второму способу у 13 из 21 (61,9%), что также не уступало пересадке двух интактных эмбрионов (61,5%) – разница достоверна при Р<0,05. Вероятно, процедура разделения эмбрионов на ранних стадиях развития и экстремальные условия in vitro в определенной степени повышают резистентность и потенции последующего развития демиэмбрионов.
Полученные результаты свидетельствуют, что микрохирургическая дисекция ранних эмбрионов не оказывает губительного воздействия на развитие демиэмбрионов, а некоторые отклонения от максимально возможного результата в исследованиях ряда авторов [5, 6, 7] связаны скорее с погрешностями в её выполнении. Данные исследований подтверждают мнение, что вероятность наступления стельности связана с интенсивностью эмбрионального сигнала, получаемого рецепторами матки от эмбриональных клеток, с увеличением числа которых уровень стельности возрастает [10]. Но результаты пересадки демиэмбрионов показывают, что эмбриональный сигнал, от которого зависит наступление беременности, связан не только с количеством эмбриональных клеток, но и с числом сигналов,
обусловленных количеством пересаженных эмбрионов, или самостоятельных в индивидуальном развитии полуэмбрионов.
В результате экспериментов по разделению ранних свежеполученных зародышей было получено 50 телят, в том числе 8 пар монозиготных близнецов (фото 2). 
В сравнительном аспекте трансплантация демиэмбрионов как по 1, так и по 2 на реципиента оказалась экономически более выгодной, чем пересадка интактных эмбрионов.
Разработанное устройство по эффективности не уступает применению манипулятора, кроме того, позволяет существенно удешевить и упростить процедуру дисекции. Может широко использоваться на практике.
ЛИТЕРАТУРА
1. А.с.1727819 СССР, МКИ5 А 61 D 19/02. Устройство для разделения эмбрионов животных / Бабенков В.Ю., Бабенкова Л.В. – № 4807032/15 (19975); Заявл. 15.02.90; Опубл. 23.04.92, Бюл. № 15 // Открытия. Изобретения. – 1992. – №15.
2. Бабенков В.Ю., Кыса И.С. Микрохирургическое разделение криоконсервированных эмбрионов // Новые методы селекции и разведения высокопродуктивных пород и типов животных: Матер. науч.-практ. конф. – Киев, 1996. – С. 305.
3. Бабенков В.Ю. Получение двоен крупного рогатого скота с использованием биотехнологических методов / Уч. зап. Витебской гос. акад. вет. медицины, 2000. – т. 36, ч. 1. – С. 126-127.
4. Дисекция деконсервированных эмбрионов. Бабенков В.Ю., Кыса И.С., Сивая Н.Н., Бабенкова Л.В. и др. // Мат. межд. науч.-практ. конф. «Актуальные проблемы интенсивного развития животноводства». – Горки, 1996. – С. 132-134.
5. Дуванов А.В. Технология получения качественных эмбрионов и пересадки полуэмбрионов. // Генет.-селекц. и технологич. пробл. развед. с.-х. жив-х: Тез. докл. науч.-практ. конф., Киев, 1994. – С. 79.
6. Жилайтис В., Анюлис Э. Изучение возможности получения монозиготного потомства коров при пересадке частично разделенных эмбрионов. // Матер. науч.-практ. конф. «Битехнология и воспроизводство в животноводстве». – БСХА, Горки, 1991. – С. 26-27.
7. Клецко Н.Г., Мадич А.В. Основы микроманипуляции с эмбрионами животных. // Бюл. науч. работ ВИЖа, 1988. – вып. 89. – С. 44-48.
8. Кыса И.С., Бабенков В.Ю., Бабенкова Л.В. Получение двоен методом трансплантации эмбрионов. // Матер. междун. науч.-практ. конф. «Сельскохозяйственная биотехнология». – Горки, 1998. – С. 255-257.
9. Кыса И.С., Бабенков В.Ю., Бабенкова Л.В., Сивая Н.Н., Вестфаль Я., Рошлау К. Практическое применение метода дисекции ранних эмбрионов. // Матер. междун. науч.-практ. конф. «Использование трансплантации эмбрионов в селекции и разведении сельскохозяйственных животных». – Киев, Аскания-Нова, 1997. – С. 36-37.
10. Эрнст Л.К., Сергеев Н.И. Трансплантация эмбрионов сельскохозяйственных животных. – М.: Агропромиздат. – 1989. – 302 с.
11.Moustafa L.F., Hahn J. Experimental production of identical twin mice. // Disch. Tierarzit. Woch. – 1978, 85. – P. 242-244.
12. Nicholas J.S., Hall B.V. Experiments on developing rates. 2. The development of isolated blastomeres and fused eggs. // J. Exp. Zool., 1942. – V. 90. – P. 441.
13.Ozil J.P., Heyman Y., Renard J.P. Production of monozugotic twins in cows by micromanipulation and cervical transfer. / Soc. Study of Fertility (Cambridge) Abstracts, 1981, p. 10.
14. Willadsen S.M., Lehn-Jensen H., Fehilly C.G., and Newcomb R. The production of monozygotic twins of preselected parentage by micromanipulation of non-surgically collected cow embryos. // Theriogenology. -1981. -15. -P.23-29.
15. Willadsen S.M., Polge C. Attempts to produce monozygotic quadruplets in cattle by blastomere separation. // Vet. Rec. – 1981. – V. 100. – P. 211-213.
Источник: журнал "Аграрное обозрение", №2, 2010 г.
Получение монозиготных близнецов КРС методом микрохирургии доимплантационных эмбрионов
- Просмотров: 15988

